4月25日,對于西安新通藥物研究股份有限公司(簡稱:新通藥物),是一個特殊的日子。
2023年4月25日,新通藥物獲得中國證監會的批復,同意其科創板首次公開發行股票的注冊申請。按照現行法規,上述批復中也明確指出:本批復自同意注冊起12個月內有效。
根據此前科創板上市企業的平均數據,上市企業從拿到證監會的注冊批文,到新股成功發行,平均用時是41天,所以理論上,12個月的有效期是一個極其寬裕的時間期限。但是,從2023年4月25日,到2024年4月25日,整整一年已經過去,新通藥物仍然沒有完成新股發行。
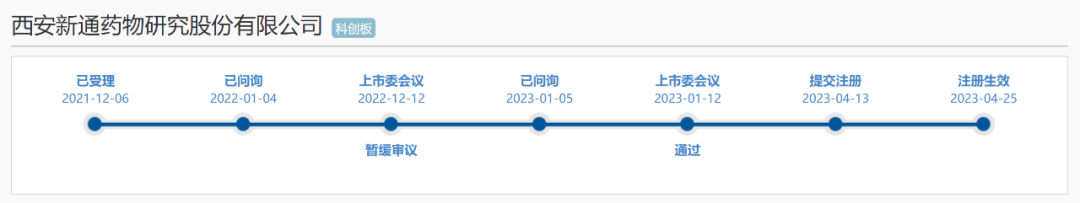
這意味著,科創板歷史上,第一家拿到IPO注冊批文后,在新股發行階段失敗的藥企,正式誕生了!位于西安的新通藥物,成立時間超過20年,最初以化學藥仿制、中藥研發起步,后續逐漸轉型為創新藥研發企業,目前主要聚焦于乙肝、肝癌等疾病領域。客觀地說,新通藥物此前的IPO之路也不是特別順利。2021年12月6日,新通藥物按照“標準五”提交IPO申請材料,在12個月之后的2022年12月12日,經歷了上會前的“暫緩審議”。一般在上會之前出現“暫緩審議”,肯定是很不好的苗頭,但是暫緩審議也并非意味著企業的上市之路就此折戟,只要發行人、中介機構能后續將相關事項核查披露清楚,按照規則還能再度上會。果然,此后新通藥物的表現非常給力,在1個月的時間內完成了問詢與回復的過程,并且在2023年1月12日順利過會。3個多月以后,新通藥物拿到證監會的IPO注冊批文,可以說距離最終的勝利已經只有吹彈可破的最后一厘米的距離。
但是非常不幸,新通藥物的IPO大業,還是倒在了這最后一厘米。截至2023年4月,新通藥物一共披露了9款在研管線,其中4款還處于臨床前的初級研發狀態。
在已經進入臨床試驗的5款藥物中,僅有1款處于1期臨床試驗的HBV 核衣殼蛋白裝配抑制劑自主研發,其余4款為都是授權引進或者合作開發的管線。
在答復審核委員會的問詢函中,新通藥物強調了自身對于引進的化合物和專利技術的原創性工作。
比如,新通藥物強調獨立完成了甲磺酸帕拉德福韋片的臨床前研究,發現最佳給藥劑量,并選擇一線對照藥物完成I期/II期/III期臨床試驗;
比如,新通藥物獨立重新完成了注射用MB07133產品臨床前研究,開發了新劑型,目前已重新完成I期/II期第一階段臨床試驗,并拓展與信迪利單抗聯合用藥治療晚期原發性肝癌的一線療法。
以上這些工作,固然也屬于研發的范疇,對于管線的發展也起了推動作用,但是能否體現硬核的“科創屬性”,就是一個見仁見智的問題了。
事實上,新通藥物的研發投入并不高,從2020年到2022年,三年研發費用分別為9254萬元、6313萬元、5485萬元。
同時,其研發工作高度依賴外部CRO。
招股說明書顯示,新通藥物與多家外部企業簽訂了臨床研究委托協議以及合作研發協議,從2020年到2022年,外包采購金額占研發投入的比重分別為74%、60%、59%。
聲明:本文觀點僅代表作者本人,不代表煜森資本立場,歡迎在留言區交流補充。如需轉載,請注明文章作者和來源。如涉及作品內容、版權和其它問題,請在本平臺留言。